БАРИЯ СУЛЬФАТ
BaSO4, бесцв. кристаллы. До 1150°С существует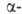 модификация
с ромбич. решеткой (а = = 0,713 нм, b = 0,885 нм, с =
0,544 нм, пространств. группа Рпта); при 1150-1580 °С- модификация
с ромбич. решеткой (а = = 0,713 нм, b = 0,885 нм, с =
0,544 нм, пространств. группа Рпта); при 1150-1580 °С-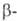 модификация
с кубич. решеткой; модификация
с кубич. решеткой;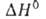 перехода
перехода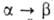 10 кДж/моль. Т. пл. 1580°С; плотн. 4,50 г/см3; Сpo
102,1 Дж/(моль*К);
10 кДж/моль. Т. пл. 1580°С; плотн. 4,50 г/см3; Сpo
102,1 Дж/(моль*К);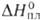 40 кДж/моль,
40 кДж/моль, Hoобр
-1459,0 кДж/моль, Hoобр
-1459,0 кДж/моль,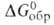 -1348,0 кДж/моль; So298 132,1 Дж/(моль*К). Практически
не раств. в воде (0,000285 г в 100 г) и разб. к-тах; раств. в конц. H2SO4
и конц. р-рах щелочей, в содержащих NH3 р-рах комплексона III,
хлорной воде, р-рах НВr и HI и гидрокарбонатов щелочных металлов. Образует
эвтектич. смеси с сульфатами Cs, К, Li, Na, Rb, Tl, BaCl2, BaF2.
Хорошо поглощает рентгеновские лучи. Диамагнитен.
-1348,0 кДж/моль; So298 132,1 Дж/(моль*К). Практически
не раств. в воде (0,000285 г в 100 г) и разб. к-тах; раств. в конц. H2SO4
и конц. р-рах щелочей, в содержащих NH3 р-рах комплексона III,
хлорной воде, р-рах НВr и HI и гидрокарбонатов щелочных металлов. Образует
эвтектич. смеси с сульфатами Cs, К, Li, Na, Rb, Tl, BaCl2, BaF2.
Хорошо поглощает рентгеновские лучи. Диамагнитен.
Б.с. встречается в природе в виде минерала барита. Получают Б.
с. из прир. залежей, взаимод. Na2SO4 или H2SO4
с
р-римыми солями Ва, а также нагреванием на воздухе сульфонилата Ba(H2NC6H4SO)2.
Синтетич. BaSO4
-наполнитель бумаги, в т.ч. фотобумаги, картона,
компонент литопона, белых минер. красок, весовая форма в хим. анализе,
контрастное ср-во при рентгенологич. исследовании пищевода, желудка и кишечника.
Лит. см. при статьях Барий, Бария гидроксид. Т. Г. Ахметов.
|