БАРИЯ ГИДРОКСИД
Ва(ОН)2, бесцв. кристаллы.
При т-рах от -273 до 246°С устойчива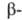 модификация;
при 246-408 °С- модификация;
при 246-408 °С-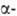 модификация
(в обоих случаях решетка ромбическая); модификация
(в обоих случаях решетка ромбическая);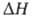 перехода
перехода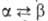 3,6 кДж/моль. Т. пл. 408 °С; Сp° 98,00 Дж/(моль*К);
3,6 кДж/моль. Т. пл. 408 °С; Сp° 98,00 Дж/(моль*К);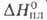 16 кДж/моль;
16 кДж/моль;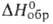 - 941,60 кДж/моль; So298 108,50 Дж/(моль*К). При
нагр. разлагается на ВаО и Н2О, ок. 800°С полностью разлагается
до ВаО; ур-ния температурной зависимости давления пара: над твердым Б.г.
lgp(na)= 14,892-184964/19,1557; над жидким lg р (Па) = 9,847-118767/19,155
Т.
Р-римость в воде (г в 100 г): 1,65 (20°С), 3,76 (40°C), 17,65 (60°С).
Насыщ. водный р-р наз. баритовой водой. Б. г. гигроскопичен. Не раств.
в спирте. В расплаве Ва(ОН)2 растворяется ВаО. Б. г.-сильное
основание; водные р-ры поглощают СО2 из воздуха. При обычных
уловиях Б. г. существует в виде октагидра та с т. пл 78°С, плотн. 2,18
г/см3; давление пара при 78°С 30,3 кПа; ур-ние температурной
зависимости давления диссоциации: lg р (Па) = 13,238 - 58230/19,1557:
При 130°С полностью обезвоживается; при упаривании кипящих водных р-ров
Б.г. в отсутствие СО2 образуется моногидрат. Получают октагидрат
действием горячей воды на ВаО, нагреванием BaS в токе влажного СО2
и перегретого пара, взаимод. р-ров ВаС12 и NaOH при кипении.
- 941,60 кДж/моль; So298 108,50 Дж/(моль*К). При
нагр. разлагается на ВаО и Н2О, ок. 800°С полностью разлагается
до ВаО; ур-ния температурной зависимости давления пара: над твердым Б.г.
lgp(na)= 14,892-184964/19,1557; над жидким lg р (Па) = 9,847-118767/19,155
Т.
Р-римость в воде (г в 100 г): 1,65 (20°С), 3,76 (40°C), 17,65 (60°С).
Насыщ. водный р-р наз. баритовой водой. Б. г. гигроскопичен. Не раств.
в спирте. В расплаве Ва(ОН)2 растворяется ВаО. Б. г.-сильное
основание; водные р-ры поглощают СО2 из воздуха. При обычных
уловиях Б. г. существует в виде октагидра та с т. пл 78°С, плотн. 2,18
г/см3; давление пара при 78°С 30,3 кПа; ур-ние температурной
зависимости давления диссоциации: lg р (Па) = 13,238 - 58230/19,1557:
При 130°С полностью обезвоживается; при упаривании кипящих водных р-ров
Б.г. в отсутствие СО2 образуется моногидрат. Получают октагидрат
действием горячей воды на ВаО, нагреванием BaS в токе влажного СО2
и перегретого пара, взаимод. р-ров ВаС12 и NaOH при кипении.
Применяют Б.г. как реактив на SO42- и CO32-,
для очистки растит. масел и животных жиров, как компонент смазок, для удаления
SO42- из пром. р-ров, получения солей Ва, а также
гидроксидов Cs, Rb из их сульфатов или карбонатов, Б.г. токсичен; ПДК 0,5
мг/м3.
Лит.: АхметовТ.Г, Химия и технология соединений бария, М., 1974;
АхметовТ.Г., ЛисинаН.В., Аналитические методы контроля производства бариевых
и сульфитных солей, М., 1974. Т. Г. Ахметов.
|