ВИРИАЛЬНОЕ УРАВНЕНИЕ
(от лат. vires - силы), ур-ние состояния
реальных газов, представляющее собой разложение давления р или фактора
сжимаемости pV/RT в ряд по отрицат. степеням молярного объема V(R - газовая постоянная, Т - т-ра):
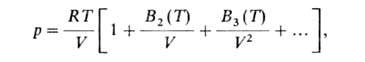
где В2, В3, ...-т.наз. вириальные коэффициенты
(В2-второй,
В3-третий и т.д.). Впервые В.у. было получено на основе
теоремы вириала, откуда и название. Первый вириальный коэф. равен единице,
поэтому для разреженных газов (>V->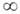 ),
а также при В2 = В3 = ... = 0 В.у.,
ограниченное первым членом ряда, переходит в ур-ние состояния идеального
газа pV= RT. Вириальные коэф. чистых газов являются ф-циями только
т-ры Т и не зависят от давления (плотности). Вириальные коэф. газовых смесей
зависят от т-ры и состава. Второй вириальный коэф. газа при низких т-pax
отрицателен, при высоких - положителен. Т-ра ТБ, при к-рой В2
= 0, наз. точкой Бойля. В точке Бойля ур-ние состояния идеального газа
применимо даже для умеренно плотных газов. ),
а также при В2 = В3 = ... = 0 В.у.,
ограниченное первым членом ряда, переходит в ур-ние состояния идеального
газа pV= RT. Вириальные коэф. чистых газов являются ф-циями только
т-ры Т и не зависят от давления (плотности). Вириальные коэф. газовых смесей
зависят от т-ры и состава. Второй вириальный коэф. газа при низких т-pax
отрицателен, при высоких - положителен. Т-ра ТБ, при к-рой В2
= 0, наз. точкой Бойля. В точке Бойля ур-ние состояния идеального газа
применимо даже для умеренно плотных газов.
Статистич. физика позволяет вычислить вириальные коэф. и их температурную
зависимость, если известен потенциал межмолекулярного взаимодействия для
данного газа. При этом В2 определяется взаимод. пар частиц,
В3 - одновременным взаимод. трех частиц и т.д. Однако надежные
сведения о потенциале межмол. взаимод. весьма ограниченны, поэтому для
расчетов вириальных коэф. на практике чаще всего используют соотношения,
основанные на соответственных состояний законе и учитывающие критич.
параметры в-ва. Экспериментально вириальные коэф. определяют по данным
о p-V-T зависимостях, вязкости газов и др.
В. у. применяют для описания газов малой и умеренной плотности, не превышающей
30-40% от критической. Для описания с помощью В. у. более плотных газов
требуется вводить большое число членов ряда. При плотностях, соответствующих
жидкому состоянию в-ва, вириалыюе разложение расходится. Для состояний
вблизи критич. точки жидкость - газ В. у. в принципе непригодно, т.к. в
этом случае зависимость термодинамич. св-в от т-ры и плотности (давления)
не имеет аналит. выражения (см. Критические явления).
Лит. см. при ст. Газы. М.А. Анисимов.
|