АЛКИЛИРОВАНИЕ
, введение алкильной (в т.ч. аралкильной) группы
в молекулу орг. соед., а также получение алкильных производных хим. элементов.
В зависимости от того, к какому атому присоединяется алкильная группа,
различают С-, О-, N- и S-A. и др.
Наиб. часто в кач-ве алкилирующих агентов используют алкилгалогениды,
алкены, эпоксисоединения, спирты, реже -альдегиды, кетоны, эфиры, сульфиды,
диазоалканы. Катализаторы А.-минеральные (H2SO4,
HF, Н3РО4) и апротонные (А1С13, BF3,
ZnCl2 и др.) к-ты, а также цеолиты и алюмосиликаты.
А. изопарафиновых и ароматич. углеводородов проводят: в жидкой фазе
в инертном р-рителе при т-рах до 100°С и давлении, необходимом для поддержания
жидкофазного состояния; в паровой фазе с применением гетерог. катализаторов
при 200-350 °С и давл. 0,3-3,5 МПа. Например, А. триметилметана бутеном
осуществляют в жидкой фазе при 0-10°С (кат. - Н25О4)
или - 10°С (HF), А. бензола этиленом-в жидкой фазе при 90-100°С (А1С13)
или паровой фазе при 250°С и давл. 3,5 МПа (BF3), А. бензола
пропиленом-в жидкой фазе при 50°С и давл. 0,7 МПа (HF) или паровой фазе
при 300°С и давл. 0,3-1,0 МПа (H3P04/Si02).
О-А. проводят при т-рах не выше 100 С в воде или орг. р-рителях, напр.:
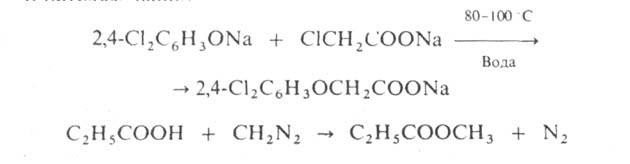
N-A. аминов спиртами осуществляют в газовой фазе в присут. кислотных
кат. при 200-300°С, напр.:
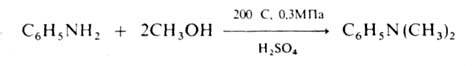
Получение алкильных производных металлов проводят в присут. меди, напр.:

А. углеводородов сопровождается полиалкилированием, изомеризацией и
полимеризацией. Так, при этилировании бензола по р-ции Фриделя - Крафтса,
кроме этилбензола, образуются ди- и полиэтилбензолы. Полиалкилирование
объясняется лучшей р-римостью в образующемся катали-тич. комплексе алкилатов
по сравнению с исходным в-вом. При использовании в кач-ве р-рителя нитрометана
идет преимуществ. образование моноалкилпроизводных. Для увеличения выхода
моноалкилпроизводных уменьшают мольное соотношение олефин : бензол, а также
проводят рециркуляцию полиалкилпроизводных, в результате к-рой идет их
деалкилирование.
Механизм А. Наиб. подробно изучен на примере С-и О-А. Р-ции с участием
алкилгалогенидов, спиртов, сложных эфиров протекают след. образом:
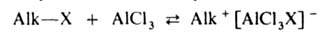 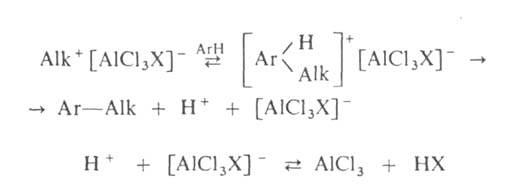
Поскольку третичные алкилгалогениды ионизируются легче всего, вторичные-труднее,
а первичные практически не ионизируются, вероятность образования соответствующих
карбкатионов уменьшается в том же ряду. Такое же влияние строения алкилирующего
агента отмечено при О-А., к-рое в целом протекает как нуклеоф. замещение
у насыщ. атома углерода:
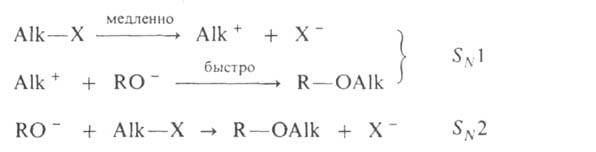
Помимо приведенных выше р-ций, А. применяют в лаб. практике для получения
алкильных производных карбонильных соед. (1-р-ция Сторка),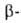 дикарбонильных
соед. (2-р-ция Тейлора-Мак-Киллопа), при хлорметилировании ароматич. углеводородов
(3-р-ция Блана): дикарбонильных
соед. (2-р-ция Тейлора-Мак-Киллопа), при хлорметилировании ароматич. углеводородов
(3-р-ция Блана):
А. широко применяется в пром-сти, в частности для получения алкилата,
этилбензола, изопропилбензола, высших алкилбензолов, ПАВ и др.
Лит.. Ингольд К., Теоретические основы органической химии, пер.
с англ., 2 изд., М., 1973; Кери Ф., Сандберг Р., Углубленный курс органической
химии, пер. с англ., кн. 1-2, М., 1981; Лебедев Н.Н., Химия и технология
основного органического и нефтехимического синтеза, 3 изд.. М., 1981; Общая
органическая химия, пер. с англ., М., 1981; Алкилирование. Исследование
и промышленное оформление процесса, пер. с англ., М., 1982. В.Ф. Травень.
|