ВАНАДИЯ ОКСИДЫ
. Характеристики наиб. важных В. о. представлены
в таблице. С увеличением степени окисления V усиливаются кислотные св-ва
оксидов, а также их хим. стойкость. Для многих В. о. характерны довольно
широкие области гомогенности (см. табл. и рис.).
Монооксид VO не раств. в воде; с разб. неорг. к-тами образует бледно-голубые
или фиолетовые р-ры солей V(II). Сильный восстановитель. Получают восстановлением
V2O5 водородом при 1700°С. Гидроксид V(OH)2,
образующийся при действии щелочей на р-р солей V(II), в индивидуальном
виде не получен.
Сесквиоксид V2O3 существует в двух кристаллич.
модификациях; при - 105°С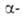 форма
превращ. в форма
превращ. в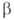 (
(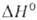 перехода
1,8 кДж/моль). перехода
1,8 кДж/моль).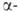 Форма
- антиферромагнетик, т-ра Нееля 168 К. В воде не раств.; с неорг. к-тами
образует соли V(III). Сильный восстановитель. Получают восстановлением
V2O5 оксидом углерода, Н2, S и др. при
нагревании. Применяют для получения ванадиевых бронз, как материал для
термисторов. Встречается в природе в виде минерала карелианита. Гидроксид
V(OH)3 образуется при действии щелочей или NH4OH
на растворы солей V(III) без доступа воздуха. Форма
- антиферромагнетик, т-ра Нееля 168 К. В воде не раств.; с неорг. к-тами
образует соли V(III). Сильный восстановитель. Получают восстановлением
V2O5 оксидом углерода, Н2, S и др. при
нагревании. Применяют для получения ванадиевых бронз, как материал для
термисторов. Встречается в природе в виде минерала карелианита. Гидроксид
V(OH)3 образуется при действии щелочей или NH4OH
на растворы солей V(III) без доступа воздуха.
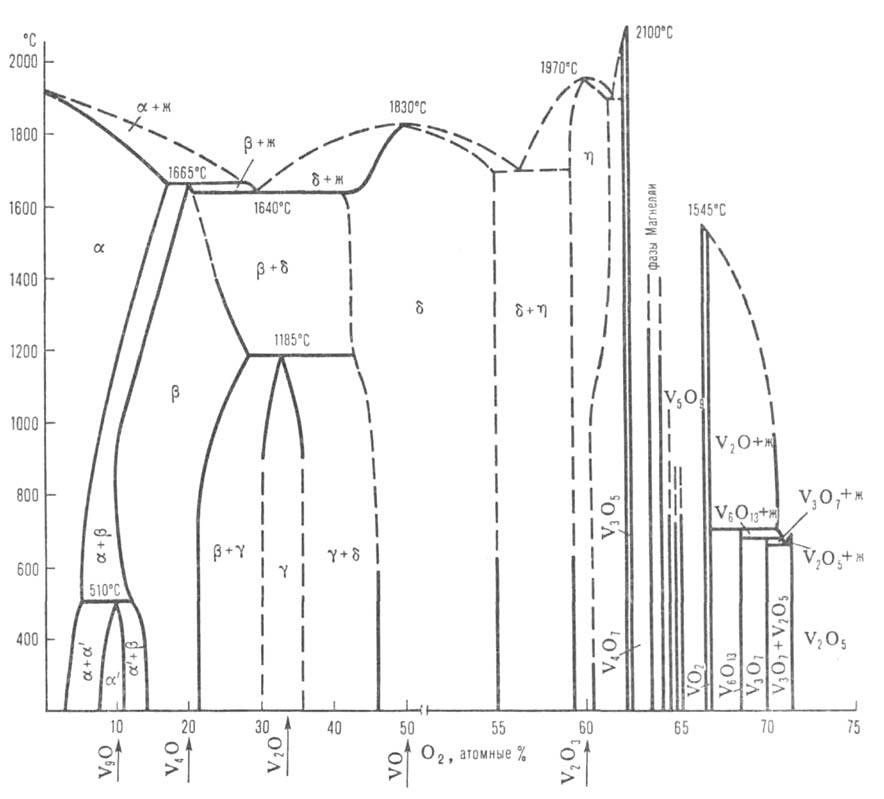
Диаграмма состояния системы ванадий-кислород: Ж-расплав; -твердые р-ры (
-твердые р-ры ( -О2 в V; -О2 в V; -на основе V9O; -на основе V9O;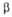 -на основе V4O; -на основе V4O;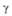 -на основе V2O; -на основе V2O;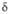 -на основе VO; -на основе VO;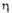 -на основе V2Оз); пунктирными линиями обозначены приблизительные границы фаз. -на основе V2Оз); пунктирными линиями обозначены приблизительные границы фаз.
Пентаоксид триванадия V3O5 - антиферромагнетик,
т-ра Нееля 270 К; при 430 К приобретает металлич. проводимость.
Диоксид VO2 существует в двух кристаллич. модификациях; при
68°С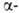 форма
превращ. в форма
превращ. в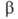 (
(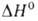 перехода
3,1 кДж/моль). перехода
3,1 кДж/моль).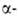 Форма
- антиферромагнетик, т-ра Нееля 345 К. Не раств. в воде. Гигроскопичен.
Амфотерен: в кислых р-рах образует катион ванадила VO2+ (р-р
приобретает светло-синюю окраску), в щелочных дает ванадаты(IV) - соли
не выделенной в своб. состоянии изополиванадиевой(IV) к-ты H2V4O9.
Восстановитель. Окисляется на воздухе. Получают сплавлением V2O5
со щавелевой к-той, нагреванием без доступа воздуха смеси V2O3
с V2O5, окислением V2O3. Применяют
в произ-ве ванадиевых бронз, как полупроводниковый материал для термисторов,
переключателей элементов памяти, дисплеев и др. Форма
- антиферромагнетик, т-ра Нееля 345 К. Не раств. в воде. Гигроскопичен.
Амфотерен: в кислых р-рах образует катион ванадила VO2+ (р-р
приобретает светло-синюю окраску), в щелочных дает ванадаты(IV) - соли
не выделенной в своб. состоянии изополиванадиевой(IV) к-ты H2V4O9.
Восстановитель. Окисляется на воздухе. Получают сплавлением V2O5
со щавелевой к-той, нагреванием без доступа воздуха смеси V2O3
с V2O5, окислением V2O3. Применяют
в произ-ве ванадиевых бронз, как полупроводниковый материал для термисторов,
переключателей элементов памяти, дисплеев и др.
Оксигидроксид VO(OH)2 - розовые кристаллы; осаждается из
р-ров при рН > 4. Амфотерен.
Пентаоксид диванадия V2O5 выше 700°С диссоциирует.
Диамагнетик. Полупроводник n-типа; ширина запрещенной зоны ~ 2,5 эВ. Р-римость
в воде 0,35 г/л при 25°С; в водных р-рах существует в виде изополиванадиевой(V)
к-ты вероятного состава H2[O(V2O5)2,5].
B кислых р-рах вероятные - формы существования V(V) - ионы VO2+
и VO3+. При нагр. таких р-ров (рН 1-2) выделяются гидраты переменного
состава V2O5*xH2O. В щелочных р-рах образуются
ванадаты(V). О произ-ве технического V2O5 см. Ванадий.
Чистый V2O5 получают разложением NH4VO3
при 400-500 °С с послед. выдержкой в струе О2, гидролизом
VOC13. Пентаоксид - промежут. продукт в произ-ве феррованадия,
ванадия, ванадатов и др. соед. V; катализатор при получении H2SO4;
компонент спец. стекол, глазурей и люминофоров красного свечения. Встречается
в природе в виде минерала щербинаита.
СВОЙСТВА ОКСИДОВ ВАНАДИЯ
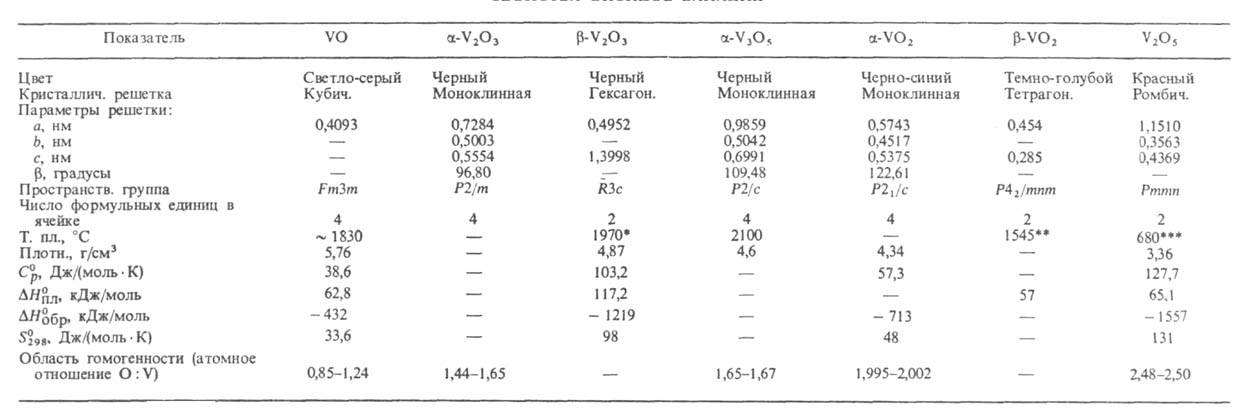
* Т. кип. - 3000°С (с разл.). ** Т. кип. ~ 2000°С (с разл.). *** Т. кип. - 2030°С (с разл.)
Известны пять В. о., образующих гомологич. ряд VnO2n-1
(фазы Магнелли), где и = 4-8. Представляют собой черные кристаллы с
триклинной решеткой. Обладают металлич. проводимостью при низких т-рах
(кроме V7O13). Антиферромагнетики. М. б. использованы
как полупроводниковые материалы для терморезисторов. Ванадий образует также
оксиды V3O7 и V6O13 - черные
кристаллы с моноклинной решеткой, плавящиеся инконгруэнтно: первый - при
660-680°С с образованием V6O13, второй - при 700-710
°С с образованием VO2. В. о. токсичны. Для V2O5
ПДК 0,1 мг/м3 (дым), 0,5 мг/м3 (пыль).
Лит.: Плетнев Р.Н., Губанов В.А., Фотиев А.А., ЯМР в оксидных
соединениях ванадия, М., 1979; Vanadiumoxide: Darstellung, Eigenschaften,
Anwendung, В., 1983. Я. Я. Слотвинский-Сидак.
|