ГЛУТАМИНСИНТЕТАЗА
[L-глутамат: аммиак лигаза (образующая АДФ)],
фермент класса лигаз, катализирующий в присут. ионов двухвалентных металлов
включение NH3 в орг. соединение:
HOOCCH2CH2CH(NH2)COOH + NH3
+ АТФ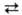 H2NCOCH2CH2CH(NH2)COOH
+ АДФ + Н3РО4, где АТФ-аденозинтрифосфат, АДФ-аденозиндифосфат. H2NCOCH2CH2CH(NH2)COOH
+ АДФ + Н3РО4, где АТФ-аденозинтрифосфат, АДФ-аденозиндифосфат.
Состоит из 4, 8 или 12 одинаковых субъединиц с мол. м. 42-65 тыс., расположенных
в два слоя. Оптим. каталитич. активность в присут. Mg2+ при
рН 7-8, а с Mn2 + -при рН 5-6. Активный центр
содержит остатки гистидина и цистеина; ингибируют активный центр L-мeтиoнин-S-cyльфoкcимин
и n-хлормеркурбензойная к-та. Аллостерич. ингибиторы (понижают скорость
ферментативной р-ции, не взаимодействуя с активным центрем)-цитозинтри-
и аденозинмонофосфат (АМФ), триптофан, глицин. Аллостерич. активаторы -
нек-рые кетокислоты.
Г. содержится во всех организмах. В клетках листьев существует в виде
двух форм (изоферментов). Одна из них находится в хлоропласте, другая -
в цитоплазме. В бактериях семейств Enterobacteriaceae и Rhizobiaceae при
избытке в среде NH3 фермент инактивируется (аденилируется):
Г. + АТФ -> Г. ~ АМФ + ПП,
где ПП-пирофосфорная к-та. Аденильный остаток в Г.~АМФ присоединяется
к группе ОН остатка тирозина. Связь между АМФ и Г. макроэргическая. Снижение
уровня NH3 в среде вызывает деаденилирование и активацию Г.:
Г.- АМФ + Н3РО4 -> Г + АДФ.
Обе р-ции катализирует фермент глутаминсинтетаза-аденилилтрансфераза.
У бактерий и синезеленых водорослей Г., по-видимому, принимает также участие
в регуляции синтеза ряда ферментов, в т. ч. нитрогеназы (см. Азотфиксация).
Лит.: Кретович В.Л., Обмен азота в растениях, М., 1972; Молекулярные
механизмы усвоения азота растениями, М., 1983, с. 198-234; Darrow R. А.,
в кн.: Glutamine: metabolism, enzymology and regulation, N.Y.-[a.о.], 1980,
p. 139-66. А. В. Пушкин.
|