ГЛИЦЕРИН
(от греч. glykeros-сладкий) (1,2,3-пропантриол) СН2ОНСНОНСН2ОН,
мол. м. 92,09; бесцв. вязкая жидкость сладкого вкуса без запаха; т. пл.
17,9°С, т. кип. 290°С (со слабым разложением); d424
1,260, пD20 1,4740;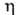 1450 мПа*с (20 °С), 280 мПа. с (40 °С);
1450 мПа*с (20 °С), 280 мПа. с (40 °С);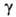 63 мН/м (20 °С);
63 мН/м (20 °С);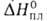 18,49 Дж/моль,
18,49 Дж/моль,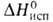 76,13 Дж/моль (195°С),
76,13 Дж/моль (195°С),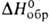 - 659,76 Дж/моль; So298 204,89 Дж/(моль*К).
Смешивается в любых соотношениях с водой, этанолом, метанолом, ацетоном,
не раств. в хлороформе и эфире, раств. в их смесях с этанолом. Поглощает
влагу из воздуха (до 40% по массе). При смешении Г. с водой выделяется
тепло и происходит контракция (уменьшение объема); глицерино-водные р-ры
замерзают при низких т-рах, напр. смесь, содержащая 66,7% Г.,-при -46,5°С
Г. образует азеотропные смеси с нафталином, рядом его производных и нек-рыми
др. соединениями.
- 659,76 Дж/моль; So298 204,89 Дж/(моль*К).
Смешивается в любых соотношениях с водой, этанолом, метанолом, ацетоном,
не раств. в хлороформе и эфире, раств. в их смесях с этанолом. Поглощает
влагу из воздуха (до 40% по массе). При смешении Г. с водой выделяется
тепло и происходит контракция (уменьшение объема); глицерино-водные р-ры
замерзают при низких т-рах, напр. смесь, содержащая 66,7% Г.,-при -46,5°С
Г. образует азеотропные смеси с нафталином, рядом его производных и нек-рыми
др. соединениями.
Благодаря наличию в молекуле трех ОН-групп Г. дает три ряда производных,
причем моно- и дипроизводные могут существовать в виде двух структурных
изомеров, а производные Г. типа СН2ХСНОНСН2ОН или
СН2ХСНХСН2ОН - в виде оптич. изомеров. Г. образует
три ряда металлич. производных - глицератов, причем они получаются даже
при взаимод. Г. с оксидами тяжелых металлов, напр. СиО. Это свидетельствует
о том, что кислотные св-ва у Г. выражены значительно сильнее, чем у одноатомных
спиртов. При взаимод. Г. с галогеноводородными к-тами или галогенидами
Р образуются моно-или дигалогенгидрины, с I2 и Р-1,2,3-трииодпропан
(нестойкое соед., распадающееся на иод и аллилиодид), с неорг. и карбоновыми
к-тами - полные и неполные сложные эфиры, при дегидратации - акролеин.
Как и все спирты, Г. окисляется; в зависимости от природы окислителя и
условий можно получить глицериновый альдегид СН2(ОН)СН(ОН)СНО,
глицериновую к-ту СН2(ОН)СН(ОН)СООН, тартроновую к-ту (НООС)2СНОН,
дигидроксиацетон НОСН2СОСН2ОН, мезоксалевую к-ту
(НООС)2СО; под действием КМnО4 или К2Сr2О7
Г. окисляется до СО2 и Н2О.
Г. содержится в прир. жирах и маслах в виде смешанных триглицеридов
карбоновых к-т. В пром-сти его получают омылением пищ. жиров, расщепляющихся
на Г. и жирные к-ты в присут. разл. катализаторов (к-т, щелочей, ферментов).
Все большее значение приобретают синтетич. методы, один из к-рых (хлоргидринный)
получил пром. применение. Он включает 4 стадии: высокотемпературное хлорирование
пропилена до аллилхлорида; взаимод. последнего с хлорноватистой к-той НОС1
с получением водных р-ров дихлоргидринов глицерина; дегидрохлорирование
дихлоргидринов до эпихлоргидрина; щелочной гидролиз последнего до Г. Метод
характеризуется большим кол-вом загрязненных сточных вод (до 60 м3
на 1 т Г.) и непроизводительным расходом хлора. На произ-во 1 т Г. идет
до 0,8-1 т пропилена и до 2,8 т Сl2.
Известны бесхлорные методы синтеза, также основанные на использовании
в кач-ве исходного сырья пропилена. Наиб. перспективно эпоксидирование
пропилена гидропероксидами или надкислотами и изомеризация полученного
пропиленоксида в аллиловый спирт с дальнейшим превращ. его в Г.
Хранят Г. в герметичных емкостях из алюминия или нержавеющей стали под
азотной подушкой. Транспортируют в алюминиевых или стальных железнодорожных
цистернах и бочках.
Г. используют для произ-ва нитроглицерина, глифталевых смол (см. Алкидные смолы), как мягчитель для тканей, кожи, бумаги, компонент эмульгаторов,
антифризов, смазок, кремов для обуви, мыл и клеев, парфюм. и косметич.
препаратов, мед. мазей, ликеров, кондитерских изделий. Произ-во Г. в 1979
в США ~ 158,9 тыс. т, в Японии ~ 70 тыс. т.
Для Г. т. всп. 198°С (в закрытом приборе), 193°С (в открытом), т. самовоспл.
362 °С; температурные пределы воспламенения 182-217°С, КПВ 2,6-11,3%; выше
90°С частично разлагается с образованием легковоспламеняющихся ядовитых
в-в, понижающих т-ру вспышки до 112°С.
Лит.: Неволин Ф. В., Химия и технология производства глицерина,
М., 1954; О шин Л. А., Производство синтетического глицерина, М., 1974.
И. А. Дьяконов.
|