ГИДРАЗИН
N2H4 (диамид), бесцв. дымящая
на воздухе жидкость с неприятным запахом. Длина связи N—N 0,1449 нм, N—H
0,1021 нм; угол HNH 106°, NNH-1120, угол между плоскостями групп
NH, 91° (гош-конформация);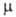 6,04*10-30 Кл*м. Т. кип 113,5°С; давление пара 18,6 гПа (25°С);
С° 98,83 Дж/(моль*К);
6,04*10-30 Кл*м. Т. кип 113,5°С; давление пара 18,6 гПа (25°С);
С° 98,83 Дж/(моль*К);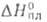 12,66 кДж/моль,
12,66 кДж/моль,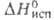 44,77 кДж/моль; So298 121,3 Дж/(моль*К);
44,77 кДж/моль; So298 121,3 Дж/(моль*К);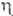 0,90мПа*с;
0,90мПа*с;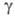 66,7 мН/м;
66,7 мН/м;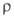 0,625*105 Ом*м;
0,625*105 Ом*м;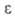 51,7; nD22 1,4695 (см. также табл.).
51,7; nD22 1,4695 (см. также табл.).
Г. смешивается в любых соотношениях с водой, жидким NH3,
спиртом; в неполярных р-рителях раств. плохо. С водой образует моногидрат,
или гидразингидрат (т. пл. -51,6°С, т. кип. 118,5°С), тетрагидрат (т. пл.
-80°С, т-ра эвтектики моногидрат-тетрагидрат -87°С), а также азеотроп (58,5
мол. % Г.; т. кип. 120,5°С). Жидкий Г. ассоциирован и слабо ионизован (2N2H4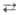 N2H5++N2H3-;
К N2H5++N2H3-;
К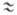 10-13).
В нем хорошо раств. ми. соли, напр. LiCl, СаС12, NaNO3,
NaClO4, Mg(ClO4)2. Большинство солей кристаллизуется
из безводного Г. и гидразингидрата в виде прочных сольватов, напр. [Li(N2H4)2]ClO4,
[Mg(N2H4)2](NO3)2.
В таких комплексах молекулы Г. служат мостиковыми бидентатными или монодентатными
лигандами. Энергия связи ионов непереходных металлов с Г. выше, чем с NH3
и водой. 10-13).
В нем хорошо раств. ми. соли, напр. LiCl, СаС12, NaNO3,
NaClO4, Mg(ClO4)2. Большинство солей кристаллизуется
из безводного Г. и гидразингидрата в виде прочных сольватов, напр. [Li(N2H4)2]ClO4,
[Mg(N2H4)2](NO3)2.
В таких комплексах молекулы Г. служат мостиковыми бидентатными или монодентатными
лигандами. Энергия связи ионов непереходных металлов с Г. выше, чем с NH3
и водой.
Г. термически малостабилен. Распад его в жидком и газообразном состояниях
происходит с выделением тепла по ур-ниям:
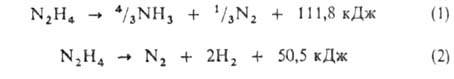
При 200-300 °С в отсутствие катализаторов преобладает направление (1).
Металлы ускоряют разложение паров Г., при этом их каталитич. активность
изменяется в ряду Ir > Rh >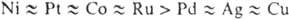 . Родий, Pt и Pd направляют процесс по р-ции (2). В присут. остальных металлов
ее вклад менее 10%.
. Родий, Pt и Pd направляют процесс по р-ции (2). В присут. остальных металлов
ее вклад менее 10%.
Г.-сильный восстановитель. Интенсивно окисляется О2 воздуха
до N2, NH3, H2O; пар Г. горит синим пламенем.
В щелочной среде окисляется медленно, ионы переходных металлов, особенно
Сu2 +, ускоряют эту р-цию. Окисляется солями
Се4+, Fe3+, Мn3+ , Со3+ до
NH3, N2 и воды, I2, Вr2, С12,
ВrO3-, IO3-, IO4-,
МnО4- до N2 и воды, Н2О2,
HNO2, S2O82-, Mo(VI) до NH3,
иногда до N2O. Нек-рые соли переходных металлов восстанавливаются
Г. до металлов.
В водном р-ре Г.-слабое основание, образующее одно-и двухзарядные ионы
гидразония:
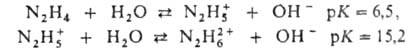
Известно большое число солей, отвечающих обеим ионным формам гидразония,
св-ва Наиб. важных из них приведены в таблице.
СВОЙСТВА ГИДРАЗИНА И СОЛЕЙ ГИДРАЗОНИЯ
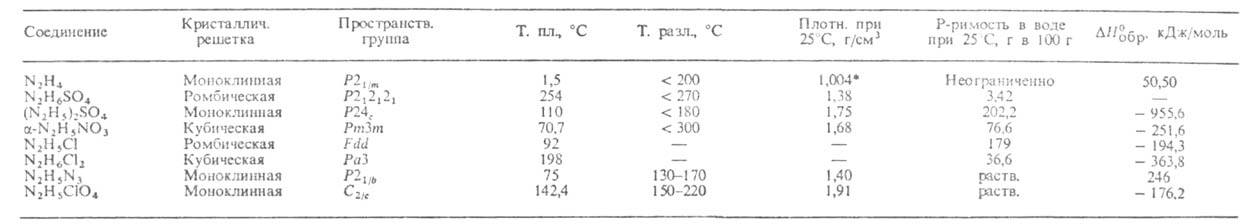
* Плотн. твердого 1,146 г/см3.
При алкилировании или арилировании Г. образуются алкил- и арилгидразины,
при р-ции с карбонильными соед.— гидразоны и азины (см. Гидразина замещенные органические). Примеры неорг. производных Г., образующихся при замещении
атомов Н,-гидразинсерная к-та N2H3SO3H,
тетрафторгидразин N2F4. При действии амидов, гидридов
или своб. металлов на безводный Г. образуются весьма взрывоопасные гидразиды,
напр. NaHNNH2, используемые как реагенты в орг. синтезе. Будучи
донором электронных пар, Г. может образовывать молекулярные комплексы с
к-тами Льюиса (L) типа N2H4*L и N2H4*2L.
Наиб. важные из них - кристаллич. гидразинборан N2H4*BH3
(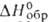 —43 кДж/моль)
и гидразинбисборан N2H4*2BH3 ( —43 кДж/моль)
и гидразинбисборан N2H4*2BH3 (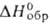 - 127 кДж/моль). Оба соед., по зарубежным данным,-энергоемкое ракетное
горючее. Г. получают окислением NH3 или CO(NH2)2
гипохлоритом Na:
- 127 кДж/моль). Оба соед., по зарубежным данным,-энергоемкое ракетное
горючее. Г. получают окислением NH3 или CO(NH2)2
гипохлоритом Na:
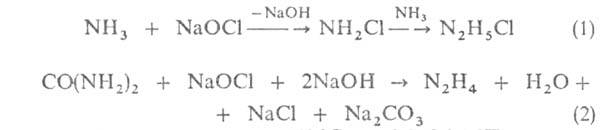
Р-цию (1) проводят при 160°С и 2,5-3,0 МПа, р-цию (2)-при т-ре выше
100oС и нормальном давлении для предупреждения побочной р-ции:
2NH2C1 + N2H4 -> N2
+ 2NH4C1 в смесь добавляют, напр., глицерин или желатину. Полученную
смесь растворяют в 50%-ной H2SO4 и получают 2-3%-ные
р-ры сульфата Г., к-рые затем обрабатывают NH3 и концентрируют
(до содержания Г. 60%) дистилляцией при нормальном давлении или в вакууме;
70-90%-ный Г. получают, напр., экстрактивной дистилляцией с анилином, 1,2,6-гексатринитрилом,
безводный Г.-обработкой гидразингидрата твердым NaOH с послед. перегонкой
над NaOH, вымораживанием конц. водного р-ра Г., пиролизом цианурата N2H4*3HCNO
при 147°С. Г. можно также получить р-цией элементного хлора с NH3
при — 30°С, илазмохимическим или радиохимическим разложением NH3.
Обнаруживают Г. по образованию окрашенных соед. с нек-рыми альдегидами,
напр. с диметиламинобензальдегидом. Г., 1,1-диметилгидразин и их смеси-горючие
компоненты в ракетных топливах. Г. используют также как горючее в топливных
элементах, ингибитор коррозии паровых котлов, для получения чистых металлов
(Си, Ni и др.) из их оксидов и солей. Г., его соли и гидраты применяют:
в произ-ве порообразователей (напр., бензолсульфонилгидразида), инсектицидов,
ВВ, регуляторов роста растений (напр., гидразида маленновой к-ты), лек.
ср-в (напр., противотуберкулезного ср-ва - гидразида изоникотиновой к-ты);
как реактивы (в частности, для обнаружения карбонильных групп, пшохлоритов
и хлоратов); для получения промежут. продуктов и красителей; в кач-ве добавок
в стекломассу (напр., для устранения тусклости стекол); как реагенты для
очистки пром. газов от СО2 и меркаптанов.
Г. и его водные р-ры сильно ядовиты, раздражают слизистые оболочки,
глаза и дыхат. пути, поражают центр. нервную систему и печень. При попадании
Г. на кожу требуется немедленная ее обработка водой или слабым р-ром к-т;
ПДК 0,1 мг/г3, пороговая концентрация, приводящая к миним. нарушениям
высшей нервной деятельности, 0,02 мг/л, концентрация 0,0039 мг/л переносится
60 мин, 0,013 мг/л-10 мин, смертельная концентрация 1-2 мг/л. Пром. сточные
воды, содержащие Г., обрабатывают С12 или хлорной известью либо
пропускают через адсорберы с активным углем, стекловатой, золой, шлаком.
Г. образует взрывоопасные смеси с воздухом и О2, способен к
воспламенению в присут. асбеста, угля, оксидов Сu, Fe, Hg и др.; в воздухе
т. всп. 270 °С (в чистом О2 и в присут. металлов и их оксидов
т-ра вспышки понижается); нижний КПВ 4,7%
Лит.: Одрит Л., Огг Б., Химия гидразина, пер. с англ., М., 1954;
Греков А.П., Веселое В. Я., Физическая химия гидразина, К., 1979; Коровин
Н. В., Гидразин, М., 1980. В. Я. Росоловский. Н.С. Торочешников.
|