ГЕРМАНИЯ ОКСИДЫ
. Диоксид GeO2-белые кристаллы.
До 1035°С устойчива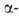 модификация
(см. табл.)-решетка тетрагональная типа рутила, построена из слегка искаженных
октаэдров GeO6 (а = 0,4395 нм, с = 0,2860 нм);
выше 1035 °С устойчив модификация
(см. табл.)-решетка тетрагональная типа рутила, построена из слегка искаженных
октаэдров GeO6 (а = 0,4395 нм, с = 0,2860 нм);
выше 1035 °С устойчив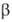 =
GeO2-решетка гексагональная типа =
GeO2-решетка гексагональная типа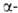 кварца,
построена из слегка искаженных тетраэдров с атомом Ge в центре (а = 0,4987
нм, с-= 0,5652 нм); кварца,
построена из слегка искаженных тетраэдров с атомом Ge в центре (а = 0,4987
нм, с-= 0,5652 нм);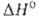 перехода
перехода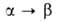 21,6
кДж/моль. Существуют также стеклообразный GeO2, тетрагональная
модификация типа 21,6
кДж/моль. Существуют также стеклообразный GeO2, тетрагональная
модификация типа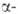 кристобалита
(образуется при кристаллизации стеклообразного GeO2 при 650
°С), кубическая типа кристобалита
(образуется при кристаллизации стеклообразного GeO2 при 650
°С), кубическая типа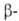 кристобалита
(получают разложением (NH4)3HGe7O17*4Н2О
при 650°). Стеклообразный GeO2 поглощает в диапазонах 0,185-0,315
мкм и 4,5-8,5 мкм. GeO2 обладает диамагн. св-вами ( кристобалита
(получают разложением (NH4)3HGe7O17*4Н2О
при 650°). Стеклообразный GeO2 поглощает в диапазонах 0,185-0,315
мкм и 4,5-8,5 мкм. GeO2 обладает диамагн. св-вами (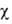 -34,3*10-6). -34,3*10-6).
СВОЙСТВА ДИОКСИДА ГЕРМАНИЯ
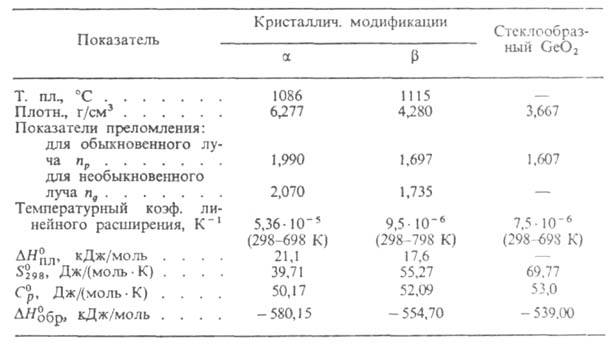
 Модификация
и стеклообразный GeO2 раств. в воде (соотв. 4,3 и 5,18 г/л при
20 °С), при этом в р-ре образуются полимерные анионы, напр. [HGe5O11]-,
[Ge5On]2-, реагируют с фтористоводородной
и соляной к-тами, раств. в р-рах щелочей (с образованием солей метагерманиевой
H2GeO3, ортогерманиевой H4GeO4
и др. к-т) и N_H3. Модификация
и стеклообразный GeO2 раств. в воде (соотв. 4,3 и 5,18 г/л при
20 °С), при этом в р-ре образуются полимерные анионы, напр. [HGe5O11]-,
[Ge5On]2-, реагируют с фтористоводородной
и соляной к-тами, раств. в р-рах щелочей (с образованием солей метагерманиевой
H2GeO3, ортогерманиевой H4GeO4
и др. к-т) и N_H3. Модификация
практически не раств. в воде (4,5*10-3 г/л при 20 °С), очень
медленно раств. в р-рах щелочей при нагр., не реагирует с фтористоводородной
и соляной к-тами. GeO2 реагирует с S при 550-900 °С и с H2S
ок. 650 °С, образуя GeS2. Восстанавливается Н2, С,
СО и нек-рыми металлами до Ge ( Модификация
практически не раств. в воде (4,5*10-3 г/л при 20 °С), очень
медленно раств. в р-рах щелочей при нагр., не реагирует с фтористоводородной
и соляной к-тами. GeO2 реагирует с S при 550-900 °С и с H2S
ок. 650 °С, образуя GeS2. Восстанавливается Н2, С,
СО и нек-рыми металлами до Ge ( -GeO2
значительно легче, чем -GeO2
значительно легче, чем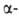 GeO2).
Образует с SiO2 и TiО 2 твердые р-ры. GeO2).
Образует с SiO2 и TiО 2 твердые р-ры.
Получают GeO2 гидролизом GeCl4 с послед. сушкой
и прокаливанием осадка при 900 °С. При этом обычно образуется смесь аморфного
и гексагон. GeO2. Для получения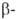 GeO2
эту смесь переплавляют, а затем нагревают при 1080°С в течение 4 ч или
медленно охлаждают от 1080 до 1050°С и выдерживают при этой т-ре в течение
5ч. GeO2
эту смесь переплавляют, а затем нагревают при 1080°С в течение 4 ч или
медленно охлаждают от 1080 до 1050°С и выдерживают при этой т-ре в течение
5ч.
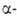 GeO2
получают при нагр. GeO2
получают при нагр.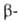 модификации
при 350 °С и выше в присут. эвтектич. смеси КС1 с LiCl либо в присут. Li2CO3
или КС1. Стеклообразный GeO2 получают нагреванием расплавленного
диоксида до 1400 °С и послед. быстрым охлаждением. GeO2 (в виде
смеси аморфного с гексагональным) м.б. получен также окислением Ge 3%-ным
р-ром Н2О2 с послед. выпариванием р-ра и прокаливанием
осадка. модификации
при 350 °С и выше в присут. эвтектич. смеси КС1 с LiCl либо в присут. Li2CO3
или КС1. Стеклообразный GeO2 получают нагреванием расплавленного
диоксида до 1400 °С и послед. быстрым охлаждением. GeO2 (в виде
смеси аморфного с гексагональным) м.б. получен также окислением Ge 3%-ным
р-ром Н2О2 с послед. выпариванием р-ра и прокаливанием
осадка.
Диоксид Ge-промежут. продукт при произ-ве Ge; компонент спец. стекол
(характеризующихся высоким коэф. преломления и прозрачностью в ИК-области
спектра), эмалей, глазурей. Из него получают др. соединения Ge, напр. германаты и фторогерманаты. Перспективно произ-во опта ч. волокна из GeO2
для систем волоконно-оптич. линий связи.
Оксид GeO-желтое или темно-коричневое аморфное в-во либо лимонно-желтые
кристаллы. Длина связи Ge—О 0,1652-0,1655 нм; энергия диссоциации 6570
кДж/моль. Т. возг. 710°С (в атмосфере N2); плотн. 4,4 г/см3;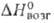 222 кДж/моль;
222 кДж/моль;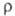 103 Ом*см. Для газообразного продукта С°р 30,81
Дж/(моль*К);
103 Ом*см. Для газообразного продукта С°р 30,81
Дж/(моль*К);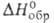 -37,7 кДж/моль; S°298 223,78 Дж/(моль*К). Выше 600 °С
диспропорционирует на Ge и GeO2. Устойчив на воздухе при обычной
т-ре, ок. 400 °С окисляется до GeO2. Незначительно раств. в
воде с образованием германиевой к-ты H2GeO2, из водных
р-ров осаждается в виде гидрата GeO*nH2O. Взаимод. с к-тами,
давая соли Ge2+, окисляется HNO3, KMnO4,
хлорной водой, Н2О2. С хлором и бромом при 250 °С
образует тетрагалогениды и GeO2. Получают GeO нагреванием смеси
Ge с GeO2 при 750 °С в атмосфере N2. Из него получают
диэлектрич. пленки.
-37,7 кДж/моль; S°298 223,78 Дж/(моль*К). Выше 600 °С
диспропорционирует на Ge и GeO2. Устойчив на воздухе при обычной
т-ре, ок. 400 °С окисляется до GeO2. Незначительно раств. в
воде с образованием германиевой к-ты H2GeO2, из водных
р-ров осаждается в виде гидрата GeO*nH2O. Взаимод. с к-тами,
давая соли Ge2+, окисляется HNO3, KMnO4,
хлорной водой, Н2О2. С хлором и бромом при 250 °С
образует тетрагалогениды и GeO2. Получают GeO нагреванием смеси
Ge с GeO2 при 750 °С в атмосфере N2. Из него получают
диэлектрич. пленки.
Лит. 9м. при ст. Германий. Н. М. Эльхонес, Л. И. Локшина.
|