ГЕКСАХЛОРЭТАН
(перхлорэтан)
С2С16, мол. м. 236,74; бесцв. кристаллы с камфарным запахом.
Имеет три кристаллич. модификации: до 43,6°С устойчива ромбич. модификация,
при 43,6-71,1 °С-триклинная, выше 71,1 °С- кубическая. Т. пл. 187°С (в закрытом
капилляре), т. кип. 185,6°С (возгоняется); d420 2,091;
давление пара (кПа) 0,1 (32,7 °С), 1,33 (73,5°С), 13,3 (124,2°С); Ср°
0,728 кДж/(кг*К) (жидкость; 25°С), 0,557 кДж/(кг*К) (пар; 25°С);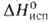 215,5 кДж/кг,
215,5 кДж/кг,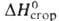 - 460,24
Дж/моль, для газа - 519,23 Дж/моль, - 460,24
Дж/моль, для газа - 519,23 Дж/моль,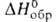 - 141,42 кДж/моль,
- 141,42 кДж/моль,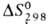 396,52 Дж/(моль*К). Г. умеренно раств. в спирте и эфире, хорошо - в CS2,
р-римость в воде 0,005% (22,3 °С); образует азеотропную смесь с водой (т. кип.
99 °С, 33,9% Г.).
396,52 Дж/(моль*К). Г. умеренно раств. в спирте и эфире, хорошо - в CS2,
р-римость в воде 0,005% (22,3 °С); образует азеотропную смесь с водой (т. кип.
99 °С, 33,9% Г.).
Энергия
связей: С—С1 299,99 к Дж/моль, С—С 263,59 кДж/моль; длина связей С—С1 0,174
нм, С—С 0,157нм, валентный угол С1СС1 109,3°.
Г. гидролизуется
твердой щелочью при 200 °С и выше, а также спиртовым р-ром щелочи до щавелевой
к-ты. В газовой фазе при 500-600 °С (или при 350-450 °С в присут. активиров.
угля) разлагается с образованием СС14 и тетра-хлорэтилена. Под
действием цинка в водной среде превращ. в тетрахлорэтилен.
Получают
Г. хлорированием полихлорэтанов (270-290 °С; кат.-активиров. уголь, паровая
фаза) или тетрахлорэтилена (100-110°С; кат.-FеС13, жидкая фаза).
В парофазном процессе Г. выделяют десублимацией, в жидкофазном-перекристаллизацией
из спирта или бензола.
Г. применяют
в произ-ве хладона 113, таблеток для дегазации при отливке алюминиевых
деталей, для получения дымообразующих смесей.
Г. не
горит и не взрывается. ПДК 10 мг/м3, в воде водоемов санитарно-бытового
водопользования 0,01 мг/л.
Лит.:
Промышленные
хлорорганические продукты. Справочник, под ред. Л.А. Ошина, М., 1978, с.
196-213. Ю.А. Трчггр.
|