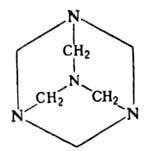
ГЕКСАМЕТИЛЕНТЕТРАМИН
(уротропин, гексамин, уризол, метенамин), мол. м. 140,19; бесцв. кристаллы,
решетка ромбоэдрическая (а=0,702нм); длина связи С—N 0,146 нм, С—Н 0,117нм;
d4251,27;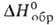 -133,5 кДж/моль,
-133,5 кДж/моль,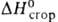 — 4220 кдж/моль; рКа 6,3 (вода; 25°С). Возгоняется в вакууме
выше 230°С, на воздухе при 280°С обугливается. Раств. в воде; образует моногидрат,
устойчивый при т-рах ниже 14°С. Р-римость (г в 100мл р-рителя): в воде-81,3
(при повышении т-ры р-римость уменьшается); хлороформе-13,4; метаноле-7,3; этаноле-2,9.
Плохо раств. в эфире, бензоле, СС14.
— 4220 кдж/моль; рКа 6,3 (вода; 25°С). Возгоняется в вакууме
выше 230°С, на воздухе при 280°С обугливается. Раств. в воде; образует моногидрат,
устойчивый при т-рах ниже 14°С. Р-римость (г в 100мл р-рителя): в воде-81,3
(при повышении т-ры р-римость уменьшается); хлороформе-13,4; метаноле-7,3; этаноле-2,9.
Плохо раств. в эфире, бензоле, СС14.
Со слабыми
к-тами Г. дает малоустойчивые соли; сильными к-тами разлагается на NH3
и формальдегид; к действию р-ров щелочей устойчив. Г.-слабый нуклеофил:
при действии бензил-, аллил- и фенацилгалогенидов образует моноалкильные
гексаминиевые соли. Последние при алкоголизе превращ. в первичные амины
(см. Делепина реакция), а при кислотном гидролизе-в альдегиды (см. Соммле реакции).
Раствор
Г. в уксусной к-те - мягкий окисляющий агент, используемый для превращ.
аминов в альдегиды или кетоны.
С фенолом
Г. взаимод. в присут. глицеринборной к-ты с образованием о- или,
если opmo-положения заняты, n-гидроксибензальдегида (см. Даффа реакция).
Ароматич.
углеводороды при нагр. с Г. в присут. трифторуксусной к-ты превращ. в альдегиды.
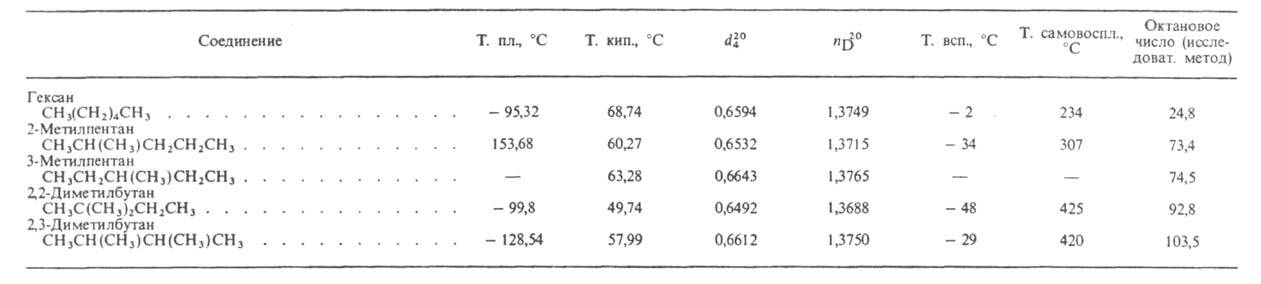
СВОЙСТВА ГЕКСАНА И ЕГО ИЗОМЕРОВ
При
нитровании дымящей HNO3 в присут. NH4NO3 и
уксусного ангидрида Г. образует ЕВ-гексаген.
В пром-сти
Г. получают выпариванием в вакууме смеси формальдегида и NH3.
Количественно его определяют титрованием NH3, выделившегося
при кислотном гидролизе. Г.-лек. препарат (напр., уротропин, кальцекс),
антисептич. ср-во; отвердитель феноло-формальд. смол; ингибитор коррозии;
фунгицид; исходный продукт в произ-ве ВВ. В аналит. химии Г. применяется
для осаждения Fe(III), A1, Cr(III), Ti(IV). Г. горюч и используется как
"сухой спирт". Впервые Г. синтезирован A.M. Бутлеровым в 1860 из NH3
и полиформальдегида.
Лит.:
Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 123-24.
Е.Н.
Караулова.
|