БОРОГИДРИДЫ МЕТАЛЛОВ
(боранаты, тетрагидридобораты, тетрагидробораты),
комплексные соед., содержащие группу [ВН4]. Последняя имеет
тетраэдрич. конфигурацию, межатомные расстояния В—Н равны 0,12-0,13 нм.
В зависимости от природы связи группы [ВН4] с металлом М различают
ионные Б.м. (М - щелочной или щел.-зем. металл) и ковалентные (М - Be,
A1 или переходный металл). Ионные Б. м.-бесцв. кристаллы (табл. 1). Раств.
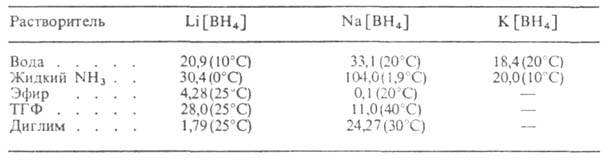
в воде, жидком NH3, аминах и нек-рых др. полярных р-рителях
(табл. 2), особенно хорошо - в эфирах этиленгликолей (диглиме, триглиме,
тетраглиме). В р-рах образуют сольваты, напр. Li[BH4]*O(C2H5)2,
Na[BH4]*nHCON(CH3)2 (n = 1, 2,
4). Число связанных молекул р-рителя редко превышает 4. Большинство молекул
сольватов довольно прочно, и их разложение требует жестких условий (нагревание,
вакуум).
Табл. 1. - СВОЙСТВА ВОРОГИДРИДОВ МЕТАЛЛОВ
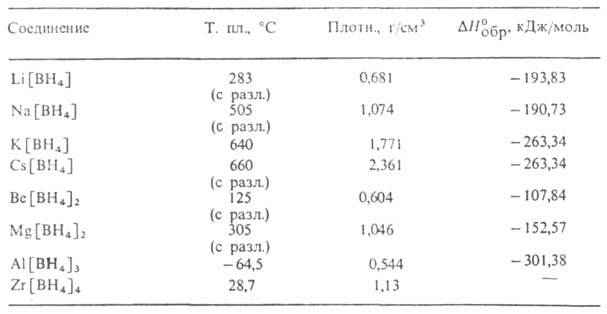
Табл. 2. - РАСТВОРИМОСТЬ БОРОГИДРИДОВ МЕТАЛЛОВ (в воде-% по массе,
в остальных растворителях - г в 100 г)
Молекулы р-рителя могут присоединяться как к катиону, так и к [ВН4]-
благодаря водородным связям.
В водном р-ре ионные Б. м. постепенно гидролизуются, выделяя Н2
(особенно быстро, когда М - щел.-зем. металл); в спиртовых р-рах реагируют
со спиртами, образуя М [B(OR)4] и Н2. Эти р-ции можно
существенно замедлить введением в р-р щелочи. Ионные Б. м. гигроскопичны,
медленно окисляются во влажном воздухе (кроме К [ВН4]). Обладают
сильным восстанавливающим действием. Атомы водорода в [ВН4]-
м. б. замещены группами Alk, Аг, AlkO, ОН, NH2, атомами галогенов
и др. К [ВН4]-могут присоединяться группы ВНx,
при этом образуются, напр., М[В3Н8], M[B2H7],
к-рые также относят к Б. м. См. также Натрия борогидрид.
Ковалентные Б. м. - кристаллы или жидкости. Молекулы содержат трехцентровые
двухэлектронные мостиковые связи В—Н—М. Большинство из этих Б. м. существует
только при низких т-рах или в виде сольватов. Легко окисляются на воздухе
(многие склонны к самовоспламенению), бурно реагируют с водой и к-тами
с выделением Н2. Обладают сильным восстанавливающим действием.
Раств. в жидком NH3 и полярных орг. р-рителях, причем р-римость
в орг. р-рителях растет с увеличением ковалентности связи М—[ВН4].
Борогидриды переходных металлов и А1 образуют с борогидридами щелочных
и щел.-зем. металлов двойные Б. м., напр. М [Zn (BH4)3],
M2[Ti(BH4)6], M[A1(BH4)4].
Б. м. получают:
1) взаимод. В2Н6 с гидридами, амидами, гидроксидами,
алкоголятами металлов, а также с металлоорг. соед., напр.:
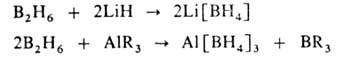
2) р-цией гидридов металлов с ВНа13, эфирами Н3ВО3,
В2О3, мета- и тетраборатами щелочных металлов, с
аминоборанами, напр.:
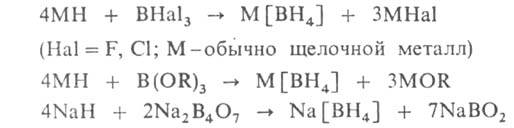
3) обменной р-цией борогидрида Na или Li с гидроксидами, галогенидами
и алкоголятами др. металлов в среде сольватирующего р-рителя, напр..
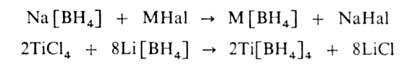
Последний метод Наиб. удобен для получения Б. м. переходных металлов.
Б. м. определяют, измеряя объем выделяющегося Н2 при их разложении
разб. соляной к-той. Известны методы определения с использованием окислителей
КIO3 и NaCIO, а также аргентометрический. Качеств, обнаружение
[ВН4]- основано на восстановлении солей нек-рых переходных
металлов (Ni, Ag и др.).
Б. м. применяют для селективного восстановления групп С=О, NO2
и C=N в орг. синтезе (напр., при пром. синтезе антибиотиков, витаминов,
стероидных препаратов); для восстановления солей при получении металлич.
высокодисперсных катализаторов, металлич. покрытий на металлах и керамике,
а также гидридов Ge, Sn, As, Sb, используемых в произ-ве полупроводниковых
материалов; в кач-ве восстановителей в аналит. химии; для синтеза борорг.
соед., боразола, боридов, В2Н6 и др. Б.м. - удобно
транспортируемые источники водорода.
Работа с Б. м. проводится в условиях, предотвращающих их контакт с О2
и влагой воздуха (в сухой камере, в атмосфере инертного газа), а также
с такими в-вами, как А1С13, ВНа13. Последние образуют
с Б. м. легковоспламеняющиеся и токсичные соединения.
Лит.: Жигач А.Ф., Стасиневич Д.С., Химия гидридов, Л., 1969;
Хайош А., Комплексные гидриды в органической химии, пер. с нем.. Л., 1971.
Н.
Т. Кузнецов.
|