АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
(от греч. aleiphar, род. падеж
aleiphatos - масло, смола, жир и kyklos - круг, кольцо) (циклоалифатич.
соединения), содержат в молекулах один или неск. циклов, состоящих из атомов
углерода (за исключением ароматич. соединений). По числу колец в молекуле
различают моноциклич. соед. (1 кольцо) и полициклические, или многоядерные
(2 кольца-бициклич., 3-трициклич. и т.д.). По взаимному расположению колец
многоядерные А.с. делят на: соединения с изо-лиров. циклами (ансамбли циклов),
причем входящие в них циклы м. б. связаны непосредственно или разделяться
одним либо неск. атомами; спирановые (имеют один общий атом С для двух
циклов)-см. также Спиросоединения; конденсированные (2 общих атома
С); мостиковые (3 и более). Разновидность мостиковых А. с.-каркасные, или
полиэдрич., соед., представляющие собой жесткие пространств. структуры,
напоминающие по форме разл. многогранники (см. также Полиэдрические соединения).
Моноциклич. А. с. по числу атомов в цикле делят на малые (3 или 4 атома),
обычные (5-7) и макроциклы, подразделяемые в свою очередь на средние (8-12)
и большие циклы (13 и более). Циклы могут содержать только простые связи
(циклоалканы), простые и двойные связи-циклоалкены (1 двойная связь), циклоалкадиены
(2 двойные связи) и т.д., средние и большие циклы-также тройные связи (циклоалкины).
В молекулах А.с. могут присутствовать функц. группы, связанные с углеводородным
циклом, напр. О (циклоалканоны), ОН (циклоалканолы), СООН (ци-клоалканкарбоновые
к-ты).
Номенклатура. Систематич. названия А.с. (в т.ч. и по номенклатуре
ИЮПАК) образуют, прибавляя приставку "цикло" к названию соответствующего
алифатич. соединения, содержащего такое же число атомов С. Примеры таких
назв.: циклопропан (ф-ла I), циклопентадиен (II), циклоно-нин (III), циклогексанон
(IV), 2-гидроксициклодеканон (V).
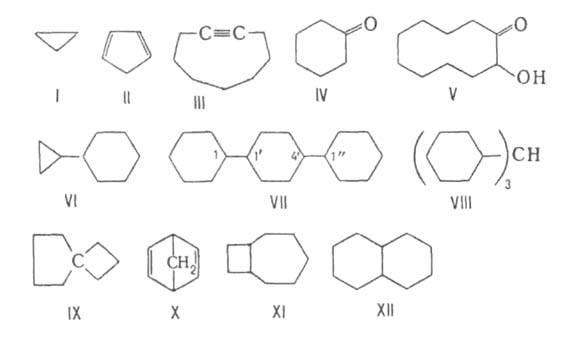
За основу назв. полициклич. соединений с изолир. циклами выбирается
наиб. цикл. Так, ансамбль из двух циклов ф-лы VI наз. циклопропилциклогексаном.
В названиях ансамблей, состоящих из одинаковых циклов, непосредственно
связанных между собой, используют приставки, соответствующие числу этих
циклов, и цифры (локанты), указывающие их взаимное расположение, напр.
1,1 :4',1"-терцик-логексан (VII). Ансамбли, в к-рых циклы разделены атомом
или группой атомов, называют как производные соответствующих алифатич.
углеводородов, напр. трициклогексилметан (VIII).
В случае спиранов за основу выбирается назв. алифатич. углеводорода
с тем же общим числом атомов С, перед к-рым ставятся приставка "спиро"
и цифры (в квадратных скобках), указывающие число атомов в каждом из циклов,
связанных со спироатомом, напр. спиро [4, 3]октан (IX). Для конденсированных
и мостиковых А. с. основой названия также служит назв. алифатич. углеводорода,
имеющего то же общее число атомов С, в приставке указывается число циклов
и после слова "цикло" цифрами - число атомов С в каждом цикле между узловыми
(общими для двух циклов) атомами, напр. бицикло [2,2,1]гептадиен (X), бицикло[5,2,0]нонан
(XI). Названия полициклич. соед., включающих 6-членные циклы, часто производят
от названий соответствующих ароматич. систем, напр. декагидронафталин,
или декалин (XII). Для обозначения систем из трех и более циклов часто
используют тривиальные названия, напр. адамантан.
Распространение в природе. Осн. источник 5- и 6-членных А. с.
в пром-сти-нефть. А.с. входят как структурные фрагменты в молекулы многих
прир. соед., напр. 3-членные моноциклич.-в пиретрины, 5-членные - в простагландины,
6-членные-в терпены. 15- и 17-Членные циклич. кетоны, обладающие мускусным
запахом, содержатся в выделениях желез нек-рых животных. Полициклич. структуры
широко представлены в нефти, а также содержатся в растительных и животных
продуктах-терпенах, стероидах, гиббереллинах.
Свойства. Циклопропан и циклобутан - газы, остальные А. с.-жидкие
или твердые в-ва. Циклоалканы имеют т-ры кипения на 10-20°С выше, а плотность
на ~ 20% больше, чем соответствующие н-алканы. Для напряженных А.
с. с малыми и средними циклами (см. Напряжение молекул)характерны
аномально высокие теплоты сгорания.
Специфич. особенности, зависящие от размера цикла, проявляются в ИК-
и КР-спектрах. Частоты валентных колебаний С—Н для ненапряженных А. с.
мало отличаются от соответствующих частот н-алканов, но они выше для напряженных
А. с. Частоты деформац. колебаний С—Н и пульсационных колебаний кольца
достаточно характеристичны и позволяют различать А. с. с разл. величиной
цикла. Определенные особенности, связанные с размером цикла, могут проявляться
и в частотах, соответствующих колебаниям заместителей и кратных связей.
Особое значение имеют стереохим. исследования А. с. В частности, работы
по конформац. анализу 6-членных А.с. послужили основой для создания этого
широко используемого метода В зависимости от размера цикл, содержащий двойную
связь, может существовать только в цис-конфигурации (3-7-членные
циклы) или в цис- и транс-формах, причем у больших циклов
более стабильны транс-изомеры. Для замещенных А. с. характерна также геом.
изомерия, зависящая от взаимного расположения заместителей по отношению
к кольцу. В полициклич. А. с., в частности в спи-ранах, встречаются особые
виды оптич. изомерии при отсутствии асимметрич. атомов, обусловленные хиральностью
молекулы в целом.
По хим. св-вам А. с. в целом аналогичны соответствующим алифатич. соединениям.
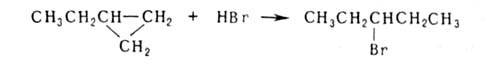
Ряд особенностей связан с их циклич. природой. Так, напряженные 3-членные
циклы легко разрываются при каталитич. гидрировании, действии галогенов,
НВг или H2SO4, напр.:
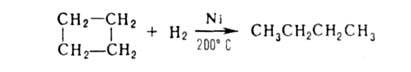
Циклобутан устойчив к действию большинства перечисленных реагентов,
но подвергается каталитич. гидрированию, хотя и труднее, чем циклопропан:
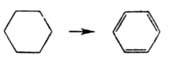
6-Членные А.с. дегидрируются в присут. катализаторов с образованием
ароматич. соединений (эта р-ция происходит при ароматизации нефтепродуктов
в пром-сти; см. Риформинг):
Многие функциональные замещенные А. с. легко претерпевают расширение
или сужение цикла, напр. Демьянова перегруппировку. Для А.
с. со средними циклами характерны особенности в физ. св-вах и специфич.
р-ции, обусловленные взаимод. непосредственно не связанных, но сближенных
в пространстве группировок, находящихся на противоположных сторонах цикла.
Ряд А. с. обладает физиол. активностью, напр. циклопропан-наркотин,
ср-во, хаульмугровая и гиднокарповая к-ты, включающие циклопентеновое кольцо,
обладают антилепрозной активностью, ряд производных адамантана-противовирусные
ср-ва.
Синтез. А.с. можно получить: 1) из ациклич. предшественников;
2) из ароматич. или гетероциклич. соединений; 3) взаимными превращениями
А. с. К первой группе методов относятся разл. способы циклизации дизамещенных соединений, напр. Дикмана реакция (для синтеза А. с.
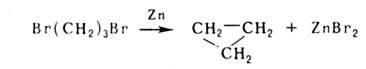
с числом атомов в цикле 5 и более); действие Zn на
дизамещенных соединений, напр. Дикмана реакция (для синтеза А. с.
с числом атомов в цикле 5 и более); действие Zn на дигалогениды (р-ция используется для синтеза гл. обр. 3-и 4-членных А.
с.):
дигалогениды (р-ция используется для синтеза гл. обр. 3-и 4-членных А.
с.):
Специфич. метод синтеза 3-членных циклов-присоединение карбенов по связи
С=С. Для получения 4-членных циклов используется (2 + 2)-циклоприсоединение,
напр.:
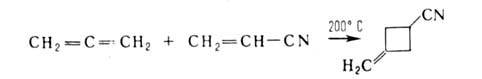
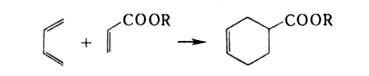
Исключительно важен диеновый синтез, приводящий к 6-членным А.с.,
напр.:
Средние циклы синтезируют циклоолигомеризацией непредельных соед., обычно
в присут. комплексных металлоорг. катализаторов. Так, циклотетрамеризацией
ацетилена получают циклооктатетраен, циклодимеризацией и циклотримеризацией
бутадиена-соотв. 1,5-циклооктадиен и 1,5,9-циклододекатриен.
Из методов второй группы Наиб. значение имеет гидри-рование ароматич.
соед., приводящее к 6-членным А. с.
Среди многочисл. способов превращения А.с., помимо уже упоминавшейся
перегруппировки Демьянова, можно отметить Фаворского реакцию и Коупа перегруппировку.
Лит.: ФизерЛ., ФизерМ., Органическая химия. Углубленный курс,
пер. с англ., 2 изд., т. 2, М., 1970, гл. 15; Общая органическая химия,
пер. с англ., т. I, ч. 2, М., 1981., Л. И. Беленький.
|