АЗУЛЕНЫ
(бицикло[5.3.0]декапентаены), небензоидные ароматич.
соед., содержащие конденсированную систему из 5- и 7-членного циклов.
Все атомы углерода 5-членного цикла несут небольшой отрицат. заряд,
7-членного (кроме атомов углерода, общих для обоих циклов) — положительный,
вследствие чего А. обладают дипольным моментом.
 А.-обычно
кристаллы синего или сине-фиолетового цвета; перегоняются с паром. Раств.
в углеводородах. Выше 300°С изомеризуются в нафталин и его гомологи. В
УФ-спектрах максимумы поглощения в области 550-700 нм. В ИК-спектрах характеристич.
полосы при частотах 1570-1577 см-1 (С—С) и 3030-3086 см-1(С-Н). А.-обычно
кристаллы синего или сине-фиолетового цвета; перегоняются с паром. Раств.
в углеводородах. Выше 300°С изомеризуются в нафталин и его гомологи. В
УФ-спектрах максимумы поглощения в области 550-700 нм. В ИК-спектрах характеристич.
полосы при частотах 1570-1577 см-1 (С—С) и 3030-3086 см-1(С-Н).
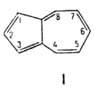
Простейший представитель А.-азулен (ф-ла I): синие кристаллы, т. пл.
99 °С, т. кип. 170°С; 3,333
* 10-30 Кл*м. Энергия стабилизации 72 кДж/моль. Гидрируется,
окисляется на воздухе и под действием КМnО4 с образованием СО2,
(СООН)2 и др. 3,333
* 10-30 Кл*м. Энергия стабилизации 72 кДж/моль. Гидрируется,
окисляется на воздухе и под действием КМnО4 с образованием СО2,
(СООН)2 и др.
А. содержатся в эфирных маслах и поэтому для них сохранились названия,
образованные прибавлением к слову "азулен" части латинского названия соответствующего
растения, напр. гвайазулен (1,4-диметил-7-изопропилазулен)-из древесины
Guaiacum officinali L., хамазулен (1,4-диметил-7-этилазулен)-из ромашки
Matricaria chamomilla L.
Вследствие повыш. электронной плотности на атомах углерода 5-членного
цикла А. проявляют высокую активность в р-циях с электроф. агентами. Они
легко образуют комплексы с электронодефицитными соед., напр. тринитробензолом, пикриновой
к-той, тетрацианхинодиметаном, карбонилами металлов. Благодаря высокой
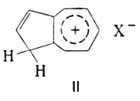
основности при действии минер. или апротонных к-т А. образуют соли, напр.
ф-лы II. Способность растворяться в 60%-ной H2SO4
или 85%-ной Н3РО4 с образованием солей используется
для выделения А., поскольку соль гидролизуется при разбавлении кислотного
раствора водой.
комплексы с электронодефицитными соед., напр. тринитробензолом, пикриновой
к-той, тетрацианхинодиметаном, карбонилами металлов. Благодаря высокой
основности при действии минер. или апротонных к-т А. образуют соли, напр.
ф-лы II. Способность растворяться в 60%-ной H2SO4
или 85%-ной Н3РО4 с образованием солей используется
для выделения А., поскольку соль гидролизуется при разбавлении кислотного
раствора водой.
 Биполярное
строение объясняет большую легкость электроф. замещения в А., чем в ароматам,
соединениях, причем первый заместитель вступает в положение 1, второй-в
3. В этих р-циях (напр., нитрование, галогенирование, ацилирование, азосочетание)
А. по реакц. способности аналогичны высокоактивным 5-членным гетероциклам.
Радикальное замещение при взаимод. А. с нитрозоацетанилидом или диазосоединениями
происходит также в положение 1 или 3. Нуклеоф. реагенты (напр., RLi, RMgX)
вступают в положение 4 или 8, а также 6. Биполярное
строение объясняет большую легкость электроф. замещения в А., чем в ароматам,
соединениях, причем первый заместитель вступает в положение 1, второй-в
3. В этих р-циях (напр., нитрование, галогенирование, ацилирование, азосочетание)
А. по реакц. способности аналогичны высокоактивным 5-членным гетероциклам.
Радикальное замещение при взаимод. А. с нитрозоацетанилидом или диазосоединениями
происходит также в положение 1 или 3. Нуклеоф. реагенты (напр., RLi, RMgX)
вступают в положение 4 или 8, а также 6.
В пром-сти А. получают дегидрированием в присут. окислителей (S или
Se) сесквитерпенов, выделяемых из эфирных масел, напр. гвайазулен синтезируют
дегидратацией гвайола, выделенного из масла древесины гваяка, с послед.
дегидрированием:
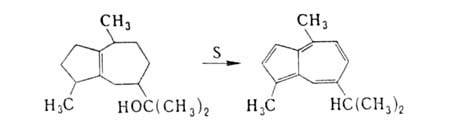
Наиб. удобен синтез из солей пиридиния или пирилия и ци-клопентадиена
или их гомологов, напр.:
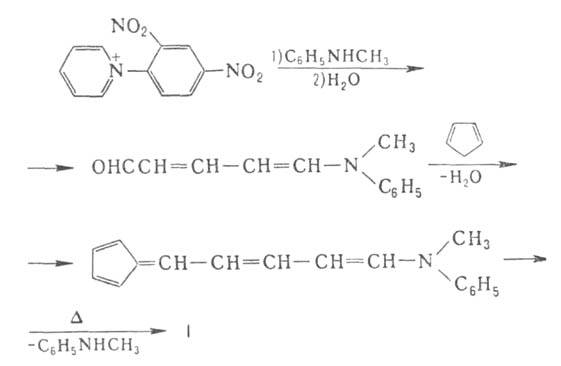
Многие А. обладают бактериостатич. и противовоспалит. активностью, благодаря
чему их широко применяют как компоненты зубных паст и косметич. изделий.
Лит.: Хельброннер Е., в кн.: Небензоидные ароматические соединения,
пер. с англ., М., 1963, с. 176-278; Мочалин В. Б., Поршнев Ю. Н., "Успехи
химии", 1977, т. 46, в. 6, с. 1002-40. Р. Я. Попова.
|